中国民间中医医药研究开发协会国际针灸合作委员会
办公地点现在已经搬迁至西城区西直门南小街国英园一号楼824室,
同时为方便大家联系,固定电话已经变更
新号码010—58562339。特此通知。
地址:北京西城区西直门南小街国英园一号楼824室
邮编:100035
电话:010-58562339
传真:010-58562339
邮箱:cngjzj@163.com
网站(点击网址直接链接↓):http://www.cngjzj.com/
博客(点击网址直接链接↓):http://blog.sina.com.cn/cngjzj
交通路线图 (点击观看大图)
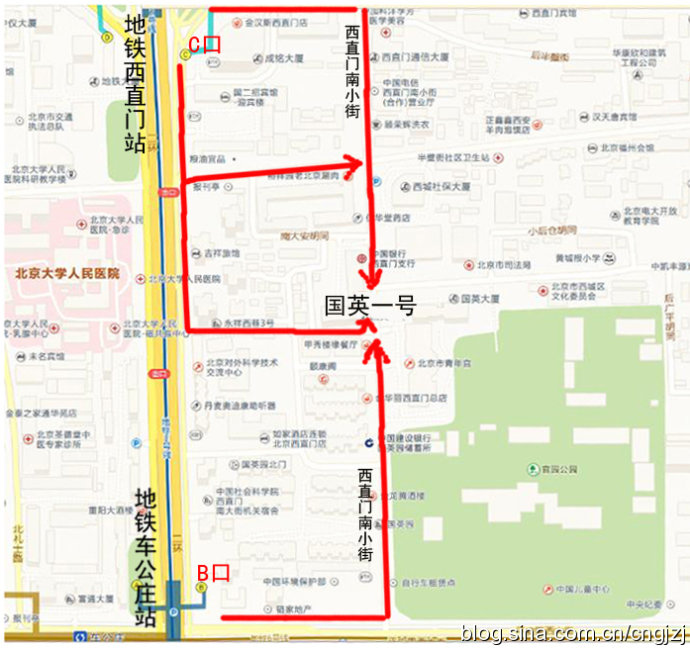
从首都机场乘坐机场专线,在东直门站下车换乘地铁2号线开往西直门方向,在西直门站 C 口出站:
1、沿西直门内大街向东直行100米,右拐到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
2、向南直行50米,绕过 国二招宾馆 沿着中大安胡同向东到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
从首都机场内乘坐机场直达西单的大巴,在西单站下车,乘坐出租车到西直门南小街国英园1号楼。
公交官园站:107路,运通106路
公交西直门南:387路,44路,800内环,816路,820内环,845路
地铁车公庄:地铁二号线
地铁西直门:地铁二号线
公交车公庄东:107路,118路,701路
公交车公庄北:209路,375路,392路
2017年04月03日
 复制链接
复制链接
 打印
打印
 大 中 小
大 中 小
审批审评改革为创新药“松绑”
2017-04-03
来源:博思网 经济日报
导读: 药品审评积压数量从近22000件下降到8200件鼓励药物研发创新是我国从医药大国走向医药强国的必经之路,但目前审批时间过长严重制约了药物创新的速度。因此,一方面要改革药物临床试验管理模式,加快新药临床试验审批;另一方面,要加快临床急需药品的上市审批,为更多创新药品上
药品审评积压数量从近22000件下降到8200件
鼓励药物研发创新是我国从医药大国走向医药强国的必经之路,但目前审批时间过长严重制约了药物创新的速度。因此,一方面要改革药物临床试验管理模式,加快新药临床试验审批;另一方面,要加快临床急需药品的上市审批,为更多创新药品上市“松绑”——
在近日举行的全国药品注册管理工作会议上,国家食药监总局副局长吴浈介绍说:“自《关于改革药品医疗器械审评审批制度的意见》发布实施一年多来,我国医药行业政策环境明显改善,医药产业发展势头良好,科技型企业不断增加,药品创新风起云涌,创新药物审评审批不断加快,扶优汰劣的效果正在显现”。
具体来看,药品注册审评效率明显提高。截至2016年底,待审评药品注册申请数量由2015年积压最高峰时的22000件减少到近8200件,注册申请积压状况得到有效缓解。在去年受理的4504件药品注册申请中,品种申报结构也明显优化。以化学药品为例,2016年接受化学创新药申请240件,较2015年增长了18%,完成新药临床试验申请和新药上市申请分别较2015年增长37%和81%。
同时,临床急需药品审评审批时限大幅缩短,公众用药可及性明显提升。其中,抗肿瘤药物瑞戈非尼片、抗感染药物苹果酸奈诺沙星胶囊、内分泌系统药物贝那鲁肽注射液、呼吸系统疾病及抗过敏药物金花清感颗粒、预防用生物制品13价肺炎球菌结合疫苗等一批应对严重公共卫生难题和重大疑难疾病的创新药和首仿药通过优先审评审批进入市场,解决了部分患者无药可用问题,大幅提升了公众对于药品审评审批制度改革的获得感。
值得注意的是,在药品新注册分类实施后,国内药物创新积极性显著提高,一批具有国际研发前沿水平的创新药物相继受理申报。截至1月31日,已经按照新分类受理化学药品注册申请达330件,其中创新药184件,占55.76%。
“创新是医药产业发展永恒的主题,是从医药大国走向医药强国的必经之路,鼓励药物研发创新也是此次药品审评审批制度改革的明确导向。”吴浈表示,目前影响药物创新最为突出的问题就是药物临床试验的审批时间太长,对创新药物抢占市场的机会影响很大。
临床试验怎么改?吴浈认为,一方面要改革药物临床试验管理模式,加快新药临床试验审批。研究对新药临床试验申请实行备案审查制,接受境外药物临床试验数据,逐步实现境内外临床数据的国际互认,降低企业的研发成本。研究将药物临床试验机构资格认定由审批制调整为备案制,提高临床试验伦理审查效能,加强药物临床试验伦理审查力度,切实保护受试者的安全和权益。
另一方面,要加快临床急需药品上市审批,有条件地批准临床急需药品。对于治疗严重危及生命且尚无有效治疗手段的疾病、解决临床需求具有重大意义的新药,申请人可根据已获得的研究数据提出减免临床试验申请;经早期临床试验结果显示初步疗效的,如符合相关原则和技术要求,可有条件批准上市;支持罕见病用药研发注册,建立扩展性同情使用临床试验药物管理制度。
此外,还要提升审评审批技术支撑能力和水平,建立食品药品监督管理总局统一指挥调度、基于风险和审评需要的检查模式,营造鼓励创新的氛围,研究制定药品试验数据保护制度,切实保护药品专利权人合法权益。
“2017年是深化药品审评审批制度改革的攻坚之年,药品注册任务之重前所未有。”国家食药监总局药化注册司司长王立丰透露,针对当前行业整体研发投入不足、研发人才缺乏、临床研究能力薄弱、药物研发创新政策生态环境尚不健全的现状,今年将研究制定进一步鼓励企业研发创新的政策措施,包括改革药物临床试验管理模式,探索有条件许可的模式,鼓励对目前缺少有效治疗手段的重大疑难疾病、罕见病用药注册申请。同时,还将开展药品生产工艺登记,建立生产工艺数据库,建立药品品种档案,建立药品目录集,指导仿制药一致性评价工作顺利开展。
“仿制药是解决医疗问题的关键,鼓励使用仿制药是世界各国包括发达国家普遍采取的政策。”吴浈表示,今年将继续以提高药品质量为核心,严把新批准仿制药的质量关,管好增量,做好已上市药品的质量和疗效一致性评价,提高存量的质量,加快推进仿制药一致性评价工作。