中国民间中医医药研究开发协会国际针灸合作委员会
办公地点现在已经搬迁至西城区西直门南小街国英园一号楼824室,
同时为方便大家联系,固定电话已经变更
新号码010—58562339。特此通知。
地址:北京西城区西直门南小街国英园一号楼824室
邮编:100035
电话:010-58562339
传真:010-58562339
邮箱:cngjzj@163.com
网站(点击网址直接链接↓):http://www.cngjzj.com/
博客(点击网址直接链接↓):http://blog.sina.com.cn/cngjzj
交通路线图 (点击观看大图)
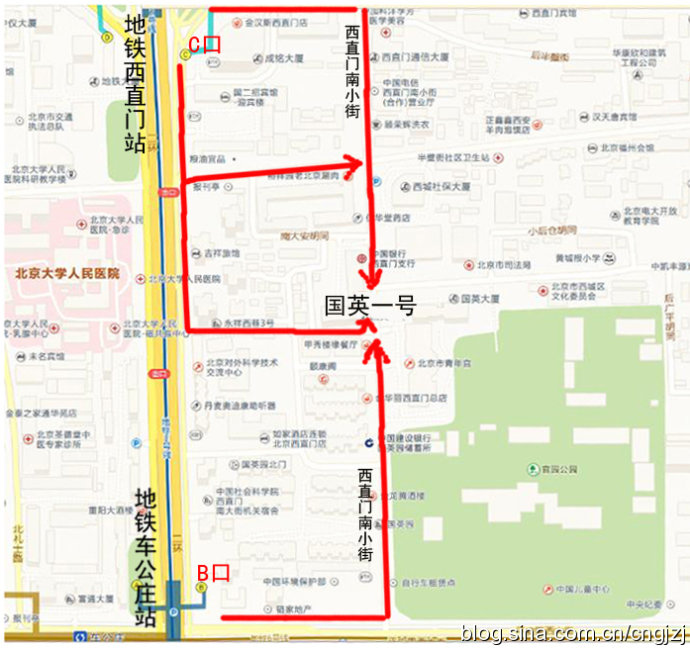
从首都机场乘坐机场专线,在东直门站下车换乘地铁2号线开往西直门方向,在西直门站 C 口出站:
1、沿西直门内大街向东直行100米,右拐到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
2、向南直行50米,绕过 国二招宾馆 沿着中大安胡同向东到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
从首都机场内乘坐机场直达西单的大巴,在西单站下车,乘坐出租车到西直门南小街国英园1号楼。
公交官园站:107路,运通106路
公交西直门南:387路,44路,800内环,816路,820内环,845路
地铁车公庄:地铁二号线
地铁西直门:地铁二号线
公交车公庄东:107路,118路,701路
公交车公庄北:209路,375路,392路
2017年04月16日
 复制链接
复制链接
 打印
打印
 大 中 小
大 中 小
阿尔茨海默症药物研发:由结构带来的启迪
2017年04月15日
来源于 财新网
作品来源:《知识分子》
撰文 | 陆珺霞(上海科技大学助理教授)
编者按:
2016年11月,美国制药巨头礼来宣布其耗费巨资研发的抗阿尔茨海默症药物solanezumab研发失败,市场对此反应强烈,礼来公司股价随即大跌14%。在阿尔茨海默症药物研发上,并非只有礼来公司折戟沉沙,很多制药公司都尝到了失败的苦头,但他们愈挫愈勇、矢志不渝。Solanezumab是针对b-淀粉样蛋白肽(A-b)可溶单体分子中间区域的抗体,该蛋白对神经有毒性,大量聚合会引起神经元的死亡。最近,一组由中外学者组成的科研小组发现,体内A-b 淀粉样纤维聚合物的结构复杂多样,这为不同类型的阿尔茨海默症的药物研发及针对不同类型的A-b 聚合物结构设计的抑制剂,提供了新思路。“知识分子”特邀这篇论文的共同作者,为这项研究进行解读。
阿尔茨海默症又名老年痴呆症。目前,中国已经成为老年痴呆症病患者最多的国家,然而只有大约21%的病人真正前去就医。老年痴呆症目前无法治愈,患者却需要长久的医疗保障,所以我们急需更加有效的诊断和治疗方法。
患有老年痴呆症的病人首先会表现出认知能力的逐渐尚失,最终死亡。从组织病理来看,该疾病一个重要的特征是获得该病病人的大脑中有大量b-淀粉样蛋白肽(A-b)的产生,并聚合成纤维状沉积。
假设阿尔茨海默症淀粉样蛋白的大量聚合会引起大脑神经元的死亡,这种蛋白纤维具有神经毒性。更多的研究发现,A-b在体外可以自聚形成多种结构的纤维,那么这种多样的结构和阿尔茨海默症又是什么关系呢?在以往的A-b 纤维结构研究中,A-b 纤维都是在体外自发聚合产生的,其结构并不一定能代表病人脑内淀粉样蛋白聚合物的结构,那么在病人的大脑中A-b 纤维的结构又是怎样的呢?
为了回答这些问题, 美国国立卫生研究院的Robert Tycko及同事摸索出了一套从捐献的病人脑组织中提取淀粉样蛋白聚合物的方法。他们发现可以再由病人脑组织样本提取的淀粉样蛋白聚合物为种子进行体外扩增,制备更多可以用来固体核磁共振(ssNMR)结构分析的淀粉样蛋白纤维。
最近,Nature杂志上报道了来至Robert Tycko研究组,由强伟为第一作者(现就职于纽约州立大学Binghamton分校)的一篇文章,用这种方法研究了18位患者共计37份脑组织样本的A-b 纤维。这些患者包括患有典型阿尔茨海默症( t-AD )和两种罕见的亚型: 快速进展型阿尔茨海默症(r-AD)和造成视觉处理障碍的后皮层萎缩型阿尔茨海默症(PCA-AD)。文章试图通过核磁谱图判断这些不同类型的阿尔茨海默症病人脑内是否具有不同构象的淀粉样蛋白纤维,寻找不同构象的淀粉样蛋白纤维和不同类型的阿尔茨海默症的关系。由于体内的A-b肽有不同的长度,最多的含40个氨基酸残基的A-b 40和含42个氨基酸残基的A-b 42,这篇文章也分别对这两个多肽淀粉样蛋白纤维进行了研究。
作者发现,对于A-b 40,在t-AD和PCA-AD的样本中,一种特异的纤维结构都占主导,并且从化学位移上判断,这一结构和该组曾经报道过的另外一位病人的A-b 40纤维结构一致。而r-AD的样本则呈现了多样不同的A-b 40纤维结构。对于这些不同类型的老年痴呆症,A-b 42的淀粉样蛋白纤维结构具有更加的多样性,缺乏统一的结构。
虽然这篇文章并没有解析出新的淀粉样纤维的结构,但文章结果告诉我们体内阿尔茨海默症淀粉样蛋白纤维结构是多样的,不同临床亚型的阿尔茨海默症的脑组织中的蛋白纤维结构是可以不同的,某些类型的阿尔茨海默症淀粉样纤维结构却是一致的。这些结构也完全不同于实验室内自发聚合形成的A-b 纤维结构。
A-b 蛋白可以聚合形成分子量巨大的蛋白纤维,也可以形成分子量较小的寡聚体结构。虽然各种聚合物结构各异,大小不一,但不论哪种A-b最具毒性,药物设计的一个关键应该是减少A-b 肽的产生或抑制其聚合。在2016年底,美国制药巨头礼来(Eli Lily &Co.)宣布放弃其对治疗轻度阿尔茨海默症药物solanezumab的进一步研究。Solanezumab是针对A-b 蛋白可溶单体分子中间区域的抗体。对于这一工作的停止,不同的人有不同的认识。许多人认为这是对阿尔茨海默症淀粉样蛋白假设的否定。除了淀粉样蛋白假设外,还有其它阿尔茨海默症致病机理的假设,比如神经炎症、tau蛋白的过度磷酸化或者葡萄糖代谢降低等。但必须指出是到目前为止,针对抑制A-b 蛋白的药物开发,还有8个处于FDA III期(phase 3)的试验药物,其中一个药物成功的希望还很大。
以上介绍的工作表明体内A-b淀粉样纤维聚合物的结构是复杂多样的,这也给药物的设计带来了难度。或许我们应该针对不同类型的阿尔茨海默症及不同类型的A-b聚合物结构设计不同的抑制剂或药物。针对阿尔茨海默症所开发的某些药物的失败或许正是因为我们忽视了其结构的多样性。