中国民间中医医药研究开发协会国际针灸合作委员会
办公地点现在已经搬迁至西城区西直门南小街国英园一号楼824室,
同时为方便大家联系,固定电话已经变更
新号码010—58562339。特此通知。
地址:北京西城区西直门南小街国英园一号楼824室
邮编:100035
电话:010-58562339
传真:010-58562339
邮箱:cngjzj@163.com
网站(点击网址直接链接↓):http://www.cngjzj.com/
博客(点击网址直接链接↓):http://blog.sina.com.cn/cngjzj
交通路线图 (点击观看大图)
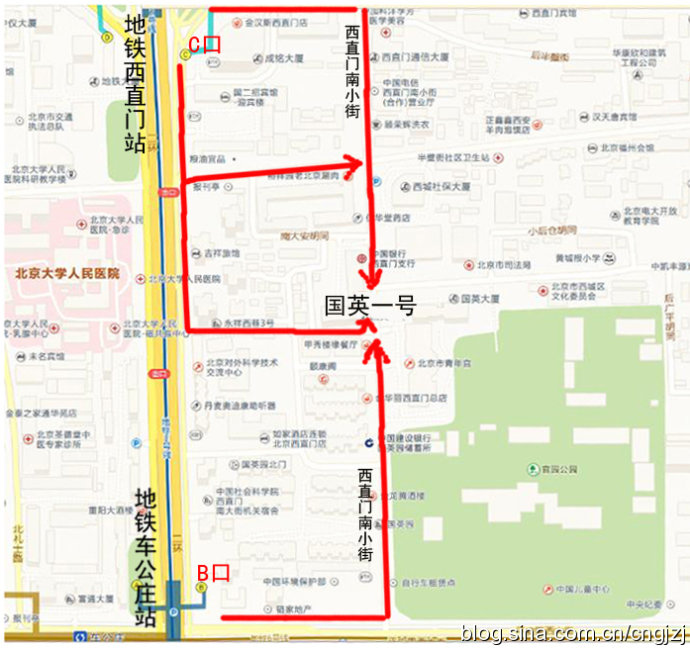
从首都机场乘坐机场专线,在东直门站下车换乘地铁2号线开往西直门方向,在西直门站 C 口出站:
1、沿西直门内大街向东直行100米,右拐到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
2、向南直行50米,绕过 国二招宾馆 沿着中大安胡同向东到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
从首都机场内乘坐机场直达西单的大巴,在西单站下车,乘坐出租车到西直门南小街国英园1号楼。
公交官园站:107路,运通106路
公交西直门南:387路,44路,800内环,816路,820内环,845路
地铁车公庄:地铁二号线
地铁西直门:地铁二号线
公交车公庄东:107路,118路,701路
公交车公庄北:209路,375路,392路
2011年03月17日
 复制链接
复制链接
 打印
打印
 大 中 小
大 中 小
针灸治疗胃溃疡蛋白质组学效应
研究平台技术优化与策略研究
作者:杨波,高洋,张燕,严兴科
【摘要】 目的为开展针灸治疗胃溃疡的蛋白质组研究,建立并优化其蛋白质组分析所需的双向凝胶电泳技术,提高其分辨率及重复性。方法对醋酸型胃溃疡大鼠进行针刺后取其胃部溃疡处组织,对组织蛋白质的提取方法进行改进,优化双向凝胶电泳的关键因素与环节,如样品的制备及预处理,第一向IPG等电聚焦的上样量及电泳参数,第二向垂直平板SDS凝胶浓度、染色方法等。利用PDQuest7.1软件分析获得的二维凝胶图像。结果以固相pH梯度-IPG胶条(pH3~10)进行第一向等电聚焦,以SDS 均一胶(12.5%)的垂直电泳为第二向,成功地得到了两组大鼠胃组织斑点分布均匀、数目较多的双向凝胶电泳图谱。结论通过对蛋白质双向凝胶电泳技术的建立及优化,获得了适合于研究胃溃疡高分辨率、高重复性的双向凝胶电泳图谱。
【关键词】 双向凝胶电泳 蛋白质组 SDS凝胶电泳
蛋白质组学是应用各种技术手段来研究蛋白质组的一门重要学科,采用蛋白质组分析应用和技术可以识别及鉴定一种细胞或组织所表达的全部蛋白质及它们的表达模式,从整体蛋白质水平上在一个更加深入、更贴近生命活动本质的层次上去探讨一些重要的生理、病理现象的本质。典型的蛋白质组研究有两个关键的步骤:①细胞或样品组织中蛋白质的分离。目前最佳的分离方法是多维色谱技术和双向凝胶电泳(two-dimensinnal electrophoresis,2-DE)。②蛋白序列的鉴定。常用质谱仪鉴别出多维色谱和2-DE等分离出的差异蛋白是一已知蛋白,还是一新蛋白[1~3]。2-DE建立于1975年,三十余年的应用和发展使其技术渐于成熟,故在多维色谱出现后,2-DE仍被广泛采用,它是蛋白质组研究的基础,亦是当代研究的关键技术。
胃溃疡是一种世界性的常见病,人群中患病率高达5%~10%,亦有报告推测,每5名男人和10名女人中,可能有一人在他们的一生中患过本病,本病严重地危害了人们的健康[1]。针灸治疗本病取得了较好的疗效,并具有简便、经济、安全、并发症发生率低和不易复发等优势,但目前对于针灸治疗胃溃疡的疗效机制尚不清楚。运用蛋白质组学思维,以2-DE为技术手段研究针刺对醋酸型胃溃疡大鼠胃组织匀浆蛋白的影响,将有助于全面、真实地揭示胃溃疡发生的病理过程以及针刺治疗本病的效应机理。
1 材料与仪器
1.1 动物
Wistar大鼠60只(长春高新医学动物实验中心),雄性,清洁级,体质量(200±30)g。
1.2 仪器
电动玻璃匀浆机、低温超速离心机、电子天平、P20、P100、P1000型精密移液器、MP3 多功能微型垂直板电泳系统(Bio-Rad)、PROTEAN II xi Cell垂直板电泳系统(Bio-Rad)、Power Pac 200和1000电源(Bio-Rad)、GS-800光密度扫描仪(Bio-Rad)、IEF/SDS-PAGE图像分析软件PD Quest 7.3.1(Bio-Rad)、SZ-93型自动双重纯水蒸馏器、TY-B型多用脱色摇床。
1.3 试剂
17cm IPG3-10预制胶条、尿素、二硫苏糖醇(DTT)、碘乙酰胺(Iodoacetamide)、丙乙酰胺(Acr, A.R.)、N,N甲叉双丙乙酰胺(Bis,A.R.)、40%载体两性电解质(Bio-Lyte 3/10 ampholytes)、矿物油(Minal Oil)以上试剂均来自美国Bio-Rad;两性去垢剂CHAPS、四甲基乙二胺(TEMED, A.R.)、过硫酸胺(APS, A.R.)、十二烷基硫酸钠(SDS, A.R.)以上试剂均来自AMRESCO;低溶点琼脂糖(Agarose, Promega)、三羟甲基氨基甲烷(Tris, A.R., BM)、氨基乙酸(Glycine, A.R., BM)、丙三醇(Glycerin, A.R., 上海化学试剂有限公司)、考马斯亮蓝R-250(CBB, R-250, A.R., 上海化学试剂有限公司)、盐酸(HCl, G.R.,上海)、硝酸银(AgNO3, A.R., 上海) 、无水碳酸钠(Na2CO3, A.R., 上海) 、硫代硫酸钠(Na2S2O3, A.R., 上海化学试剂有限公司)、牛血清白蛋白标准品(BSA, 上海)、苯甲基磺酰氟(PMSF, 上海)。
2 方法
2.1 设计将60只大鼠随机分为3组:正常对照组、模型组、针刺治疗组。采取乙酸涂抹法造模,术后24 h开始正常喂养,针刺治疗组对足三里、中脘进行毫针针刺,10 d为1个疗程。10 d后取3组胃组织进行观察与研究。
2.2 样品处理胃组织总蛋白的提取:于溃疡模型成功后处死大鼠,分别取出正常对照组与模型组观察溃疡形成情况,取针刺治疗组大鼠胃溃疡处组织进行处理,予冰盐水反复清洗干净,以去除血液, 并尽可能剪去多余的其他组织,滤纸吸去多余的液体,立即置液氮中速冻,后移至-80 ℃低温冰箱保存。将已处理过的标本从-80 ℃冰箱中取出,称取针刺治疗组大鼠胃组织。分别采取传统方法及改良方法,下面仅介绍改良方法,在讨论部分介绍二者区别。剪取约200 mg组织,加入2.0 ml细胞裂解液(8 mol/L的尿素,4%的CHAPS,100 mmol/L的DTT,40 mmol/L的Tris-base和0.5%的两性电解质),在冰水混合物中以1 500 r/min仔细制备匀浆,反复冻融3个循环,加入20 μg/ml DNase I 10 μl和5 μg/ml RNase A 10 μl,在冰浴中1 500 r/min匀浆10 min。转移至离心管,4℃作用15 min后,以15 000 r/min离心30 min,收集上清液即为蛋白质粗提物,-80℃冷冻保存待用。
2.3 样品浓度测定Bradford法[4]。
2.4 双向电泳
2.4.1 第一向固相pH梯度(IPG)等电聚焦参照Gorg A等[5]的方法略有改动。取上述蛋白质样品,按1 mg的上样量计算出蛋白质上样体积,依该体积加入蛋白质样品,加入样品缓冲液至终体积300 μl,在液体涡旋仪及手掌型离心机上分别混匀。取出-20℃冷冻保存的IPG预制胶条(17 cm pH 3~10),室温中放置10 min。而后,用镊子去除IPG胶条上的保护层。将样本均匀加入胶槽中,胶面向下放入17 cm IPG干胶条,胶条的正极对应于聚焦盘的正极并与电极紧密接触,避免气泡产生,然后滴加覆盖矿物油3ml,需缓慢地一滴一滴将矿物油加在胶条的塑料支撑膜上。对好正、负极,盖上盖子。将聚焦槽水平放入等电聚焦仪中,设置程序。自动程序电泳参数设置见表1。表1 等电聚焦的程序(略)
2.4.2 平衡等电聚焦后迅速取出IPG 胶条,在桌上先放置干的厚滤纸,聚焦好的胶条胶面朝上放在干的厚滤纸上。将另一份厚滤纸用MilliQ水浸湿,挤去多余水分,然后直接置于胶条上,轻轻吸干胶条上的矿物油及多余样品。将胶条胶面朝上转移至溶涨盘中,每个槽一根胶条,并加入10 ml平衡缓冲液I。将样品水化盘放在水平摇床上平衡15 min。第1次平衡结束后,彻底倒掉或吸掉样品水化盘中的胶条平衡缓冲液I。并用润湿的滤纸吸取多余的平衡液(将胶条竖在滤纸上,以免损失蛋白或损坏凝胶表面)。再加入胶条平衡缓冲液II,将胶条胶面朝上转移至加有平衡缓冲液II的溶涨盘中, 继续在水平摇床上缓慢摇晃15 min。第2次平衡结束后,彻底倒掉或吸掉样品水化盘中的胶条平衡缓冲液II。并用润湿的滤纸吸取多余的平衡液。将IPG胶条从样品水化盘中移出,并完全浸末在1×电泳缓冲液中。
2.4.3 第二向垂直SDS——聚丙烯酰胺凝胶电泳配制12.5%的均匀SDS聚丙烯酰胺凝胶。用滤纸吸去SDS聚丙烯酰胺凝胶上方玻璃板间多余的液体。将低熔点琼脂糖封胶液进行加热溶解(中火1 min左右)。将IPG胶条从1×电泳缓冲液中移出,胶条一端放上低分子量蛋白标记10 μl,然后将胶条胶面朝上放在凝胶的长玻璃板上。用镊子轻轻地将胶条向下推,使之与聚丙烯酰胺凝胶胶面完全接触,避免在胶条下方产生气泡。而后在IPG胶条上注入加热溶解好的低熔点琼脂糖,待低熔点琼脂糖封胶液完全凝固后,将凝胶转移至电泳槽中。电泳参数:初始电压80 V约5 min,以后200 V直至溴酚蓝前沿抵达胶边缘处为止。
2.4.4 考染显色将凝胶从玻璃板上剥离下来,放置在干净的染色盘中。采用Bio-Safe Coomassie stain染色法。考染步骤将凝胶浸于去离子水中,摇床上漂洗2次,10 min/次;加入适量Bio-Safe考马斯亮蓝R-250以使凝胶完全浸没,摇床上1 h或过夜。最后将胶浸入去离子水中,摇床上脱色至底色脱去。
2.4.5 凝胶图象采集与分析应用GS800扫描仪器采集凝胶图象,用PDQuest二维分析软件对电泳图谱进行分析。
3 结果
3.1 针灸治疗组胃组织蛋白质的提取率和上样量 样品蛋白质浓度在5~5.5 g/L。双向电泳的上样量在185~195 μl。
3.2 针灸治疗组胃组织蛋白质2-DE的分辨率和重复性 平均含(350±50)个蛋白点,匹配率85.56%。
3.3 实验改进图片
选择宽pH 范围(pH 3~10)的固相线性17 cm 干胶条和12.5%的均匀SDS聚丙烯酰胺凝胶, 采用初始80V电压5 min,然后以200 V恒压电泳,直至溴酚蓝指示线到达凝胶底边处停止电泳,可以得到斑点分布均匀、数目较多的双向凝胶电泳图谱。如图1 和2所示。
4 讨论
近年来对于胃溃疡的发病机制的研究取得了一定的进展,发现了许多与疾病发生、发展有关的因素及分子调控机制,尤其是基因组学的研究有了很大进展,但影响疾病发生、发展的重要机制是蛋白质分子种类和功能状态的改变。蛋白质组的研究可能为这些疾病发病机制的研究开辟一条新的道路,该方法改变了以往研究只能针对一种或一类蛋白质的限制,使研究机体复杂多变的蛋白质群体成为可能。特别是在研究针灸治疗疾病的机制方面,蛋白质组学的思路与中医的整体观念有着相似的观点。2-DE技术是蛋白质组研究的核心技术,该技术主要用于分离细胞或组织蛋白质粗提物,构建特定组织或细胞的蛋白质“二维参考图谱”,分析特定时间与生理状态下蛋白质的表达情况,进行蛋白质组差异比较。通过这种差异的比较,可以为我们提供进一步的研究线索,从整体水平把握研究方向。
建立针灸治疗胃溃疡组织蛋白组学效应研究平台,为探索针灸疗效机制提供了新方法、新技术和新模式。对已有平台进行优化必将极大地加速研究进程,尽早地获得研究成果,有利于针灸理论发展和临床应用。
4.1 样品制备从组织中提取蛋白质的影响因素很多,寻找理想的方法尽可能完全地抽提细胞和组织中全部蛋白质一直是双向凝胶电泳标本预处理研究的热点和难点。本法将组织置于冰盐水中清洗干净,立即置-80℃冰箱中速冻保存,可以去除黏膜表面杂质、黏液和血细胞,保持蛋白的完整性,最大程度地减少蛋白降解和丢失。由于不同组织中疏水性蛋白质、亲水性蛋白质、低丰度蛋白质、高丰度蛋白质和极端等电点蛋白质同时存在,很难用单一抽提液和方法将不同组织细胞中的蛋白质完全制备出来。为提高组织蛋白质的溶解性,提高蛋白质的提取浓度,我们主要注意了两个环节:一是样品裂解液的选择;二是充分的组织匀浆、超高速离心。样品裂解液中较高浓度的尿素(8 mol/L)能破坏氢键,溶解并使蛋白质变性、解折叠。DTT通过断裂半胱氨酸的二硫键,打开蛋白质分子内键,从而促进蛋白质溶解。CHAPS在含有尿素的溶液中具有较好的水溶性,促进疏水性蛋白质的溶解。为去除其他干扰蛋白质溶解的物质,如核酸、脂肪酸和盐离子,尤其是核酸,与蛋白质结合后,会产生人工假象和条纹,所以在裂解液中加入微量的DNA酶和RNA酶,以减少干扰,消减背景。充分的组织匀浆、超速离心等都是利用机械力来对蛋白分子解聚。超速离心被用来去除溶液中干扰蛋白溶解的其它物质。通过上述步骤,可以提取出组织的绝大多数蛋白成分。
4.2 上样量选择提高上样量有利于低丰度蛋白质的检测。但上样量过高,高丰度蛋白质的斑点过大会影响其他蛋白质点的分离和分析,而且样本量过高,其在重泡胀液体系中所占体积过大,可能导致重泡胀不充分,影响IPG等电聚焦的效果。因此在样品处理后,选择合适的上样量对获得高质量的2-DE图谱尤为重要。我们研究发现在考马斯亮蓝染色的2-DE体系中上样量在lmg,可以得到较理想的2-DE图象。
4.3 固相pH梯度等电聚焦选择宽pH范围(pH 3~10)的固相化线性17 cm干胶条。IPG等电聚焦时初始电压缓慢递增,容易使样品进入凝胶,即使是不易分离的蛋白质分子在低电压持续作用下也能向其等电点缓慢移动。因此采用了初始电压为250 V,且逐渐递增至10 000 V的聚焦程序,从而使聚焦完全。
4.4 第二向垂直的SDS-PAGE电泳参数设置为80v约5 min,然后以200 V恒压电泳,直至溴酚蓝指示线到达凝胶底部停止电泳。对于分离胶的浓度,选择了12.5%,结果斑点分布均匀,数目较多。
4.5 蛋白质染色2-DE不同的染色方法对样本量的要求不同。传统的考马斯亮蓝染色技术由于其较低的成本、使用方便和与下游的蛋白质鉴定技术的良好相容性得到了非常广泛的使用,但其对样本量的要求较高,通常1 mg左右的上样量才能检测到100 ng级的蛋白质[6,7]。银染技术比考染灵敏度高,可检测到1 ng级的蛋白质。但银染步骤非常繁杂,胶与胶之间的重复性较差,有文献报告其差异可达20%[8],而且银染由于需要加入醛类作为固定剂,所以干扰质谱分析的结果[9],与蛋白质鉴定技术的相容性还有待改进。因而我们的实验体系选择Bio-Safe Coomassie stain染色法,它具有操作简单、省时、重复性较好、可检测到ng级的蛋白量等优势,便于为今后的工作提供有利条件。
双向凝胶电泳技术是蛋白质组学研究的核心技术之一,探索将其用于针灸治病机理的研究是时代发展的需要,更是中医药发展的需要。虽然我们采取了一系列措施来对针灸治疗胃溃疡蛋白质组学效应研究平台进行技术优化与策略分析,但在双向凝胶电泳图谱中仍依稀可见许多水平条文,故今后的重点是如何提高双向凝胶电泳的分辨率和重复性,以便开展大规模分析。我们的研究也尚处于初试阶段,优化技术平台只是基础工作,最终目的在于通过高分辨率和高重复性的双向电泳图谱进行差异蛋白的筛选和鉴定,以此为针灸治疗胃溃疡的机理研究提供理论依据和技术支撑。
【参考文献】
[1]Jain KK.Recent advances in oncoproteomics[J].Curr Opin Mol Ther.2002,4(3):203.
[2]Wbonyoung Choi.Sonya W.Song,Wei Zhang.Understanding Cancer through Proteomics[J].Technology in Cancer Research & Treatment,2002,l(4):221.
[3]陈主初,梁宋平.肿瘤蛋白质组学[M].长沙:湖南科学技术出版社,2002.
[4]Bradford MM,A rapid and sensitive methcM for the quantitation of microgram of protein utilizing the principle of protein dye binding[J].Anal Biochem,1976,72:248.
[5]Gorg A,Obermaier C,Boguth G,et a1.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis,2000,2l(6):1037.
[6]Ha GH,Lee SU,Kang DG,et a1.Proteome analysis of human stomach tissue:separation of soluble proteins by two-dimensional polyacrylamide gel electrophoresis and identification by mass spectrometry[J].Electrophoresis,2002,23(15):25l3.
[7]章波,粟永萍,刘晓宏,等.小鼠小肠七皮细胞经γ射线照射后蛋白质组差异分析[J].中华放射医学与防护杂志,2003,23(4):234.
[8]Quadroni M,James P.Proteomies and automation[J].Electrophoresis,1999,20(4-5):664.
[9]姜楠,霍海如,姜廷良.蛋白质组检测技术进展[J].国外医学·卫生学分册,2004,3l(1):55.