中国民间中医医药研究开发协会国际针灸合作委员会
办公地点现在已经搬迁至西城区西直门南小街国英园一号楼824室,
同时为方便大家联系,固定电话已经变更
新号码010—58562339。特此通知。
地址:北京西城区西直门南小街国英园一号楼824室
邮编:100035
电话:010-58562339
传真:010-58562339
邮箱:cngjzj@163.com
网站(点击网址直接链接↓):http://www.cngjzj.com/
博客(点击网址直接链接↓):http://blog.sina.com.cn/cngjzj
交通路线图 (点击观看大图)
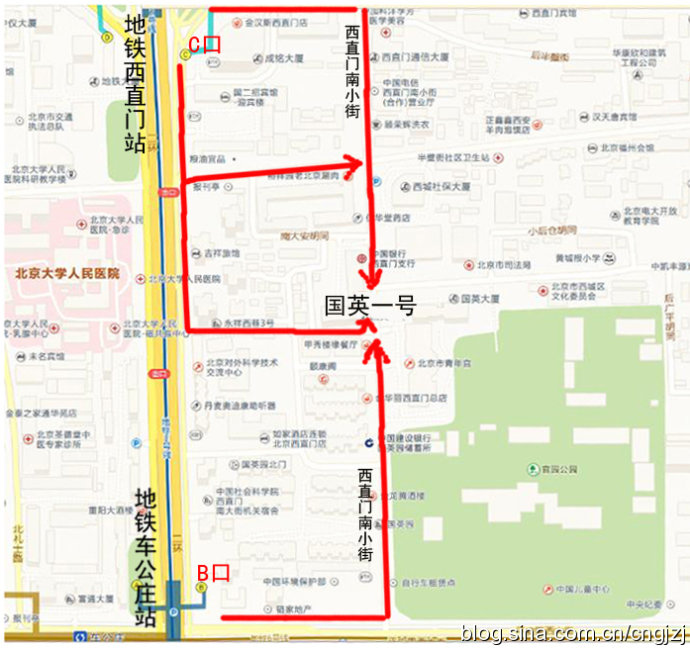
从首都机场乘坐机场专线,在东直门站下车换乘地铁2号线开往西直门方向,在西直门站 C 口出站:
1、沿西直门内大街向东直行100米,右拐到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
2、向南直行50米,绕过 国二招宾馆 沿着中大安胡同向东到西直门南小街,向南步行到丁字路口即到国英园1号楼楼下。
从首都机场内乘坐机场直达西单的大巴,在西单站下车,乘坐出租车到西直门南小街国英园1号楼。
公交官园站:107路,运通106路
公交西直门南:387路,44路,800内环,816路,820内环,845路
地铁车公庄:地铁二号线
地铁西直门:地铁二号线
公交车公庄东:107路,118路,701路
公交车公庄北:209路,375路,392路
2018年11月19日
 复制链接
复制链接
 打印
打印
 大 中 小
大 中 小
科学变更工艺 提升中药质量
2018-11-09 健康报
中药产业目前已成为我国国民经济的战略产业,随着中药现代化和国际化进程的稳步推进,也必将在服务“一带一路”等重大战略中发挥更大作用。而这一切的前提就是要有安全、有效、质量可控的中药产品。如果将中药产品的质量作为“果”的话,它的“因”又有哪些呢?
笔者认为,无外乎以下两条:一是先天注定的原料药材质量。中药材质量源于天然,受品种基源、产地(气候、土壤)、生长年限、种植(养殖)方式、采收时节、炮制方法等多种因素的影响。虽然目前很多学者从基源鉴定、科学种植、评价标准等方面进行了深入研究,但由于中药材质量的形成过程过于复杂,很难找到科学的干预方法,使得原料药材的质量一致。二是中药产品生产过程中工艺因素。比如煎煮、渗漉、浓缩、醇沉、层析、萃取、混料、压片等工艺又取决于多种工艺参数。长期以来,人们习惯于按照既定的工艺参数按部就班地生产,但问题来了:变化的原料,加上固定的工艺,能得到一致性的产品吗?答案当然是否定的。
做好质控避免“合格假药”
如何才能找到一条适合中药产品生产制造的途径呢?笔者认为,需要从以下两个方面着手:
其一,原料药材的质量还是要控制的。炮制虽繁必不敢省人工,品味虽贵必不敢减物力。如果先天原料质量低劣,任凭后天如何加工,也改变不了最终产品的质量。所以,必须对中药材原料实施质量控制。问题是我们如何控制。长期以来,无论是政策层面,还是实际操作层面,人们习惯将个别化学成分的含量作为控制药材质量的金科玉律,这当然是出于政策法规的可执行性、具体操作的标准化等因素考虑,但也越来越多地引起从业人员的质疑,比如为药材制定标准时,什么含量高测什么,什么容易测测什么,什么有标准品测什么……而对于这些指标与安全性、有效性的关系缺少深入研究,对于中药化学成分之间的协同增效作用重视不够,以至于最终出现“合格的假药”。
当然,我国科学家已经意识到现行方法的不足,并正着手改进。比如中国工程院院士刘昌孝近年来提出的“中药质量标志物”概念,解放军第302医院全军中医药研究所所长肖小河教授提出的“中药材生物评价”等理念,都是非常有益的尝试。
笔者认为,在对中药材实施质量控制时,一定要考虑其整体性质,大类物质(比如黄酮类物质、酚酸类物质、皂苷类物质)总量及构成如何,小分子物质与大分子物质、水溶性成分与脂溶性成分比例如何,各类成分之间相互作用如何等。所以,需要探索色谱之外新的分析方法,能够更为综合、全面地反映药材原料的整体性质,并为其设定一个可量化的控制范围,这样才能实现真正意义上的质量控制。
其二,在中药生产过程中,要推行柔性工艺的理念。所谓柔性工艺,就是根据原料药材的质量波动,寻找最为匹配的工艺和参数,从而得到一致性较高的中药产品。这实质上就是将前馈控制理念运用到中药生产领域,在了解原料属性、工艺参数与产品质量之间关系的基础上,建立工艺参数优化模型,然后根据原料属性计算得到合适的工艺参数操作范围,从而减少原料属性波动对于产品质量的影响。这种理念有利于提升中药产品的质量以及生产过程的稳健性,对于中药生产的标准化和现代化有着重要意义。
中药生产工艺如何变更
欣喜的是,原国家食品药品监督管理总局已经意识到中药生产原有工艺存在不足,并组织制定了《已上市中药生产工艺变更研究技术指导原则》,为解决目前中药生产的困境指明了方向。笔者认真学习了这个法规文件,其中的亮点有以下几条:
其一,将工艺变更分为微小变更、中度变更、重大变更三类,分类的目的是便于申请人有针对性地确定变更研究内容,有效开展研究。但无论何种类别的变更,都不应对药品的安全性、有效性产生负面影响。这个规定也可以解读为,只要对药品的安全性和有效性不产生负面影响,工艺变更都是可以考虑的,当然工艺变更路线要经得起考核,效果应经得起检验。
其二,已上市中药工艺变更研究应遵循“必要、科学、合理”原则和“安全、有效、质量可控”原则。工艺变更的提出与研究是基于对拟变更工艺的了解,是以既往工艺研究阶段以及实际生产过程中的研究和数据积累为基础的。前期研究工作越系统、深入,生产过程中积累的数据越充分,对上市后的工艺变更研究越有帮助。申请人应对其产品的研发和生产过程、产品的性质等有着全面和准确的了解,应当清楚变更的原因、变更的程度,并以“质量源于设计”的思路和理念开展生产工艺变更研究。
其三,在提交的工艺变更申报资料中,要求简述生产工艺的选择依据和优化过程,列出相应的工艺步骤及主要工艺参数控制范围,并提供详细的工艺路线、工艺方法、工艺参数界定,或辅料种类和用量筛选的研究资料。笔者认为,“主要工艺参数控制范围”内涵丰富,首先是主要工艺参数,而不是所有工艺参数;其次是控制范围,而不是固定的工艺参数。这样变更后的工艺就可以在允许的范围内进行微调,以适应原料的变化。
虽然该《指导原则》出台后,网上时有部分从业人员的“吐槽”,但实事求是地说,它无疑将对我国中药智能制造、改进传统的生产方式和历史原因造就的生产工艺,全面提高中药生产水平和中药产品质量起到很大的推动作用。